Definicja produktów farmaceutycznych niebędących lekami według Japońskiej 'Ustawy o Urządzeniach Farmaceutycznych i Medycznych'? O możliwościach wyrażania ich właściwości i efektów w reklamach
W firmach produkujących towary farmaceutyczne niebędące lekami oraz w punktach sprzedaży takich jak apteki, sprawdzanie zgodności z Japońską Ustawą o Urządzeniach Medycznych (Pharmaceutical and Medical Device Act) jest codziennym zadaniem zarządzania ryzykiem. Jednakże, ze względu na niejednoznaczność standardów reklamowych dopuszczalnych w ramach tej ustawy, trudno jest dokonać właściwej oceny, co może prowadzić do niezamierzonych naruszeń.
W tym artykule, prawnik wyjaśni jak prawidłowo formułować twierdzenia dotyczące skuteczności i efektów produktów farmaceutycznych niebędących lekami, które są wymagane podczas składania wniosków i reklamowania, aby zapobiec niezamierzonemu naruszeniu Japońskiej Ustawy o Urządzeniach Medycznych.
Co to są produkty lecznicze niebędące lekami według japońskiego Prawa Farmaceutycznego i Medycznego (薬機法)?
Artykuł 2, ustęp 2 japońskiego Prawa Farmaceutycznego i Medycznego (Ustawa o zapewnieniu jakości, skuteczności i bezpieczeństwa produktów farmaceutycznych i medycznych) definiuje “produkty lecznicze niebędące lekami” (医薬部外品) w następujący sposób:
W tej ustawie “produkty lecznicze niebędące lekami” oznaczają substancje o łagodnym działaniu na organizm człowieka, które są:
1. Stosowane do celów wymienionych od (a) do (c) poniżej (z wyjątkiem tych, które są stosowane również do celów określonych w punktach 2 i 3 poprzedniego ustępu) i które nie są urządzeniami ani aparaturą:
(a) Zapobieganie nudnościom, innym dolegliwościom lub nieprzyjemnemu zapachowi z ust lub ciała
(b) Zapobieganie potówkom, odparzeniom itp.
(c) Zapobieganie wypadaniu włosów, stymulowanie wzrostu włosów lub usuwanie włosów
2. Stosowane do celów zapobiegania szkodliwym organizmom, takim jak myszy, muchy, komary, pchły i inne podobne, dla zdrowia ludzi lub zwierząt (z wyjątkiem tych, które są stosowane również do celów określonych w punktach 2 i 3 poprzedniego ustępu) i które nie są urządzeniami ani aparaturą
3. Te, które są stosowane do celów określonych w punktach 2 i 3 poprzedniego ustępu (z wyjątkiem tych wymienionych w punktach 1 i 2) i które są wyznaczone przez Ministra Zdrowia, Pracy i Opieki Społecznej
W skrócie, “produkty lecznicze niebędące lekami” to substancje, które działają na organizm człowieka z siłą pośrednią między “lekami” a “kosmetykami”, a ich działanie na organizm człowieka jest łagodniejsze w porównaniu z “lekami”. Na przykład, kosmetyki lecznicze, napoje odżywcze, farby do włosów, pasty do zębów, antyperspiranty, środki na porost włosów, środki owadobójcze itp. są uważane za “produkty lecznicze niebędące lekami”.
Warto zauważyć, że w wyniku zmiany “Rozporządzenia wykonawczego do Prawa Farmaceutycznego” w roku Heisei 11 (1999 r.) produkty, które zostały przeniesione z “leków” do “produktów leczniczych niebędących lekami”, są nazywane “nowo wyznaczonymi produktami leczniczymi niebędącymi lekami”, a te, które zostały przeniesione w wyniku zmiany w roku Heisei 16 (2004 r.), są nazywane “produktami leczniczymi niebędącymi lekami o nowym zakresie”. Te produkty są objęte definicją “wyznaczonych produktów leczniczych niebędących lekami” określoną w punkcie 3 artykułu 2, ustęp 2 Prawa Farmaceutycznego i Medycznego.
“Produkty lecznicze niebędące lekami” zawierają składniki skuteczne wobec określonych przez Ministerstwo Zdrowia, Pracy i Opieki Społecznej właściwości i efektów w określonym stężeniu, i są tworzone głównie w celu “zapobiegania” chorobom, a nie “leczenia”. Ponadto, oznaczenie “lecznicze” jest dozwolone tylko dla “produktów leczniczych niebędących lekami”, które mają łagodniejsze działanie niż leki, więc “lecznicze = produkty lecznicze niebędące lekami”.
Niezależna Agencja Rządowa ds. Produktów Farmaceutycznych i Medycznych (PMDA) wyjaśnia definicję i cechy “produktów leczniczych niebędących lekami” w następujący sposób:
1. Działanie na organizm człowieka jest łagodne. (Artykuł 2, ustęp 2 Prawa Farmaceutycznego i Medycznego)
2. To nie są leki. (Artykuł 2, ustęp 1 i 2 Prawa Farmaceutycznego i Medycznego, Komunikat Dyrektora Biura nr 464 z dnia 6 września roku Showa 37, itp.)
① Produkty, których składniki i ilości lub istota przekraczają zakres dopuszczalny dla produktów leczniczych niebędących lekami, są traktowane jako leki, niezależnie od ich skuteczności lub efektów.
② Nawet jeśli składniki i ilości lub istota są w zakresie dopuszczalnym dla produktów leczniczych niebędących lekami, produkty, których skuteczność, sposób użycia lub dawka przekraczają ten zakres, są traktowane jako leki.
3. Produkt nie jest jednym z wymienionych poniżej. (Komunikat Dyrektora Biura nr 464 z dnia 6 września roku Showa 37)
a. Substancje odpowiadające truciznom lub silnym lekom
b. Czyste substancje
4. Głównym celem użycia jest “zapobieganie”. (Komunikat Dyrektora Biura nr 464 z dnia 6 września roku Showa 37, itp.)
※ Dla nowo wyznaczonych produktów leczniczych niebędących lekami i produktów leczniczych niebędących lekami o nowym zakresie, proszę zobaczyć powiązane komunikaty itp.
5. Jest to produkt, którego ciągłe stosowanie jest przewidywane na co dzień.
6. Zasada jest taka, że nie jest to produkt, który jest używany pod nadzorem profesjonalistów medycznych, takich jak lekarze czy farmaceuci.
“Podstawowe uwagi dotyczące składania wniosków o zatwierdzenie produktów leczniczych niebędących lekami (wersja na rok 2021)”[ja]
Więcej informacji na temat kryteriów klasyfikacji produktów farmaceutycznych i medycznych według Prawa Farmaceutycznego i Medycznego można znaleźć w poniższym artykule.
Artykuł do odniesienia: “Co to jest Prawo Farmaceutyczne i Medyczne (dawne Prawo Farmaceutyczne)? Wyjaśniamy cel, zakres regulacji i regulacje dotyczące reklamy”[ja]
O możliwościach wyrażania właściwości leczniczych i efektów w przypadku produktów leczniczych niebędących lekami

W przypadku “produktów leczniczych niebędących lekami” (japońskie: 医薬部外品), Ministerstwo Zdrowia, Pracy i Opieki Społecznej określa zakres możliwych do wyrażenia właściwości leczniczych i efektów, zależnie od rodzaju produktu. Reklamowanie produktu poza tym zakresem jest naruszeniem japońskiego Prawa o Urządzeniach Farmaceutycznych i Medycznych.
Wyrażanie skuteczności w przypadku ogólnych kosmetyków i kosmetyków leczniczych
Jak już wcześniej wspomniałem, kosmetyki lecznicze, które są lekami dostępnymi bez recepty, mogą reklamować nie tylko skuteczność składników aktywnych, ale także 56 efektów, które mogą być wyświetlane w ogólnych kosmetykach, co pozwala na bardziej skuteczną reklamę niż ogólne kosmetyki.
【Różnice między ogólnymi kosmetykami a lekami dostępnymi bez recepty】
| Ogólne kosmetyki | Kosmetyki lecznicze | |
| Zakres skuteczności | 56 efektów określonych przez Ministerstwo Zdrowia, Pracy i Opieki Społecznej | Zatwierdzona skuteczność + skuteczność ogólnych kosmetyków |
| Zawartość składników aktywnych | Brak | Tak |
Podczas reklamowania skuteczności kosmetyków leczniczych, które są takie same jak w przypadku ogólnych kosmetyków (56 efektów określonych przez Ministerstwo Zdrowia, Pracy i Opieki Społecznej), należy zwrócić uwagę na następujące trzy punkty:
- Nie wprowadzać w błąd, że jest to kosmetyk, ukrywając pierwotny cel leku dostępnego bez recepty.
- Nie jest to produkt, który może stanowić problem z punktu widzenia higieny publicznej, gdy jest używany dla celów kosmetycznych, takich jak szampon z dodatkiem środka dezynfekującego lub mydło lecznicze.
- Nie wprowadzać w błąd, że dany efekt został zatwierdzony jako skuteczność leku dostępnego bez recepty.
Szczegółowe kryteria oceny, czy skuteczność i wyrażenie w reklamach leków dostępnych bez recepty, w tym kosmetyków leczniczych, naruszają prawo farmaceutyczne, można znaleźć w “Wyjaśnieniu i uwagach dotyczących standardów właściwej reklamy leków itp.”[ja] Ministerstwa Zdrowia, Pracy i Opieki Społecznej oraz w “Wytycznych dotyczących właściwej reklamy kosmetyków itp.”[ja] Japońskiego Stowarzyszenia Przemysłu Kosmetycznego.
Przykłady wyrażeń, które naruszają Japońską Ustawę o Farmaceutach i Urządzeniach Medycznych
Wśród słów kluczowych, które mogą naruszać Japońską Ustawę o Farmaceutach i Urządzeniach Medycznych oraz regulacje dotyczące reklamy medycznej, dobrze znanym jest wyrażenie “anti-aging”.
Anti-aging (ang. Anti-Aging) oznacza “zapobieganie i leczenie objawów związanych ze starzeniem się, zapobieganie starzeniu, przeciwdziałanie starzeniu, przeciwdziałanie starzeniu się”.
Ministerstwo Zdrowia, Pracy i Opieki Społecznej w Japonii wyraziło następujące stanowisko na temat wyrażenia “anti-aging” w swoim “Wytycznych dotyczących reklamy medycznej”[ja] (opublikowanych 8 maja 2018 roku (rok Heisei 30)).
Kliniki anti-aging lub (po prostu) anti-aging nie są uznawane jako nazwy specjalności medycznych, a także nie są objęte publicznym ubezpieczeniem zdrowotnym ani leczeniem za pomocą leków i urządzeń medycznych zatwierdzonych na mocy Japońskiej Ustawy o Farmaceutach i Urządzeniach Medycznych, dlatego nie są akceptowane jako reklama.
W „Podsumowaniu czwartego spotkania grupy roboczej ds. medycyny i opieki”[ja], które odbyło się w grudniu 2018 roku (rok Heisei 30), znajduje się następujący opis (niektóre wyrażenia zostały zmienione z oryginalnego tekstu, aby pasowały do treści).
“Ministerstwo Zdrowia, Pracy i Opieki Społecznej nie twierdzi, że wszystko, co jest określane jako anti-aging, jest złe. Nie można jednak łatwo zaakceptować czegoś, co jest po prostu określane jako anti-aging. Co więcej, jeśli spełnione są odpowiednie warunki, można dostarczać informacje nie tylko o “możliwościach reklamowych”.
Na podstawie powyższego, użycie wyrażenia “anti-aging” w reklamie medycznej jest zasadniczo niedozwolone, ale może być wyjątkowo dozwolone, jeśli spełnione są wymagania dotyczące ograniczeń w Wytycznych dotyczących reklamy medycznej i jeśli celem jest wyjaśnienie treści procedury medycznej. Ponadto, “anti-aging” jest wyrażeniem, które ogłasza farmaceutyczne skutki i efekty, dlatego nie można go używać w reklamie produktów farmaceutycznych dostępnych bez recepty.
Z drugiej strony, istnieją podobne wyrażenia, takie jak “opieka nad starzeniem się” i “środki przeciw starzeniu się”, ale w przeciwieństwie do “anti-aging”, nie są to wyrażenia, które opisują procedury medyczne lub farmaceutyczne skutki i efekty. Dlatego mogą być one publikowane w produktach farmaceutycznych dostępnych bez recepty, jeśli są w granicach zatwierdzonych skutków i efektów.
“Opieka nad starzeniem się” odnosi się do opieki za pomocą kosmetyków itp. odpowiednich do wieku. W reklamie produktów farmaceutycznych dostępnych bez recepty, nie można używać wyrażenia “opieka nad starzeniem się” w celu ogłoszenia “leczenia” lub “poprawy” chorób klasyfikowanych jako farmaceutyczne skutki i efekty. Można go używać tylko wtedy, gdy można go zinterpretować jako “opiekę nad skórą zgodnie z wiekiem, która jest uznawana za skutek i efekt kosmetyków itp.”, biorąc pod uwagę kontekst przed i po.
W ten sposób, podczas gdy “anti-aging” jest wyrażeniem, które oznacza procedury medyczne i farmaceutyczne skutki i efekty, “opieka nad starzeniem się” jest wyrażeniem, które oznacza “opiekę dostosowaną do obecnego stanu”, dlatego ma wysoką zgodność z kosmetykami i produktami farmaceutycznymi dostępnymi bez recepty.
Ponadto, wyrażenia “bielenie” i “wybielanie” mogą być również używane, jeśli są używane zgodnie z pewnymi zasadami, takimi jak jednoczesne użycie z efektem makijażu.
Proszę odnieść się do „Wytyczne dotyczące odpowiedniej reklamy kosmetyków itp.”[ja] dla konkretnych przykładów użycia każdego wyrażenia dozwolonego na mocy Japońskiej Ustawy o Farmaceutach i Urządzeniach Medycznych.
Artykuł do przeczytania: Uwagi dotyczące wyrażeń reklamowych kosmetyków i żywności zdrowotnej[ja]
Uwagi dotyczące produkcji i sprzedaży produktów leczniczych niebędących lekami

W przypadku produkcji i sprzedaży produktów leczniczych niebędących lekami, wymagane jest zezwolenie lub zatwierdzenie Ministra Zdrowia, Pracy i Opieki Społecznej lub gubernatorów poszczególnych prefektur. W tym artykule omówimy podstawowe kwestie, na które należy zwrócić uwagę przy uzyskiwaniu wymaganych zezwoleń w procesie dystrybucji produktów leczniczych niebędących lekami.
Po pierwsze, w celu produkcji i sprzedaży (wysyłki) produktów leczniczych niebędących lekami, konieczne jest uzyskanie zezwolenia na produkcję i zezwolenia na produkcję i sprzedaż od gubernatora każdej prefektury (Artykuł 12 i 13 Japońskiej Ustawy o Urządzeniach Medycznych i Farmaceutycznych, Artykuł 80 ustęp 2 Rozporządzenia wykonawczego do Ustawy o Urządzeniach Medycznych i Farmaceutycznych). Zauważmy, że do produkcji produktów leczniczych niebędących lekami za granicą wymagane jest uzyskanie certyfikacji producenta zagranicznego od Ministra Zdrowia, Pracy i Opieki Społecznej (Artykuł 13(3) Japońskiej Ustawy o Urządzeniach Medycznych i Farmaceutycznych).
Ponadto, podczas rzeczywistej produkcji i sprzedaży produktów leczniczych niebędących lekami, dla każdego produktu, musisz złożyć wniosek o zatwierdzenie produkcji i sprzedaży do organu regulacyjnego (Ministra Zdrowia, Pracy i Opieki Społecznej lub gubernatora każdej prefektury) i uzyskać zatwierdzenie dotyczące bezpieczeństwa, skuteczności i jakości (Artykuł 14 Japońskiej Ustawy o Urządzeniach Medycznych i Farmaceutycznych).
Wnioski o różne zezwolenia, o których mówiliśmy powyżej, składa się do gubernatora prefektury, w której znajduje się miejsce produkcji lub biuro sprzedaży. Z drugiej strony, wnioski o zatwierdzenie dla poszczególnych produktów są składane do Ministra Zdrowia, Pracy i Opieki Społecznej lub do gubernatora prefektury (w przypadku produktów leczniczych niebędących lekami, które nie są kosmetykami leczniczymi, część uprawnień do zatwierdzania jest delegowana do gubernatorów poszczególnych prefektur).
Kategorie wniosków o “produkty lecznicze niebędące lekami” są podzielone na 11 grup, w zależności od składników, ilości, skuteczności, efektów itp., a rodzaje wymaganych dokumentów dołączonych różnią się, więc należy zachować ostrożność.
Szczegółowe informacje można znaleźć w publikacji Niezależnej Organizacji Administracyjnej ds. Leków i Urządzeń Medycznych (PMDA) “Procedura produkcji i sprzedaży produktów leczniczych niebędących lekami”[ja].
Proszę sprawdzić poniższy diagram dotyczący procesu wnioskowania o zezwolenie i zatwierdzenie.
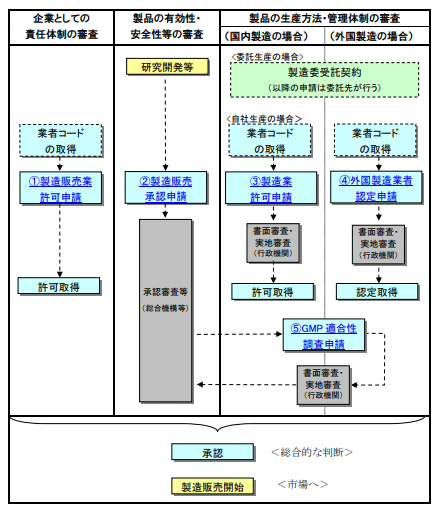
“Procedura produkcji i sprzedaży produktów leczniczych niebędących lekami”
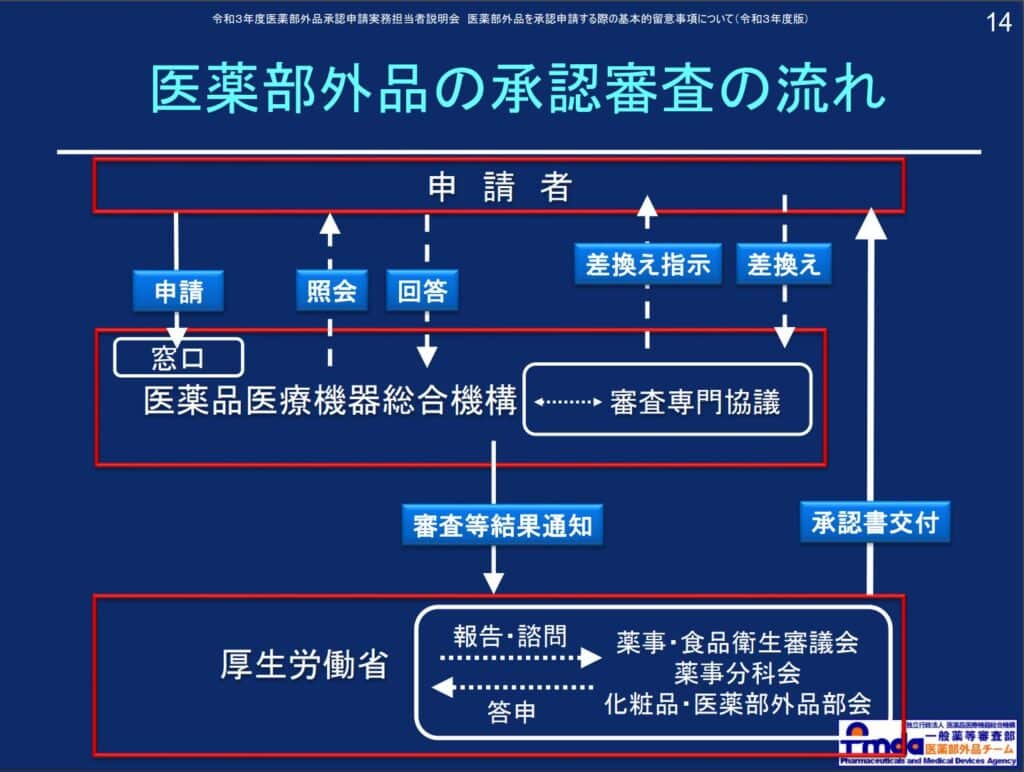
Co więcej, składniki aktywne, które mogą być zawarte w “kosmetykach leczniczych” i “produktach leczniczych niebędących lekami”, można znaleźć w publikacji Ministerstwa Zdrowia, Pracy i Opieki Społecznej “Lista składników aktywnych w tzw. kosmetykach leczniczych”[ja].
Ponadto, w “produktach leczniczych niebędących lekami” wymagane jest oznaczenie 140 wybranych substancji chemicznych jako składniki określone (składniki ogłoszone). Szczegółowe informacje można znaleźć w “Składniki produktów leczniczych niebędących lekami i kosmetyków określone przez Ministra Zdrowia, Pracy i Opieki Społecznej”[ja].
Podsumowanie: Sprawdzenie zgodności z prawem farmaceutycznym powinno być przekazane prawnikowi
W wyniku zmiany w prawie farmaceutycznym (japońskim: Yakkihō) w roku pierwszym ery Reiwa (2019), system kar administracyjnych w postaci grzywien został wprowadzony jako regulacja reklam leków i innych produktów. Zaostrzono kary za naruszenie regulacji reklamowych prawa farmaceutycznego. Wytyczne dotyczące reklamowania leków i innych produktów są corocznie aktualizowane, dlatego od osób prowadzących działalność gospodarczą, agencji reklamowych i innych zainteresowanych, które zajmują się obsługą i rozważaniem reklam leków i innych produktów, wymaga się ostrożnego podejścia.
Interpretacja prawa farmaceutycznego i ocena, czy wyrażenia używane w reklamach są odpowiednie, może być trudna do samodzielnego ustalenia. Dlatego, jeśli masz jakiekolwiek wątpliwości, zalecamy skonsultowanie się z prawnikiem specjalizującym się w sprawdzaniu zgodności z prawem farmaceutycznym.
Sprawdzanie zgodności z prawem farmaceutycznym i proponowanie zmian wyrażeń to obszar o bardzo wysokim stopniu specjalizacji. Kancelaria prawna Monolis tworzy zespół prawników specjalizujących się w prawie farmaceutycznym, który obsługuje sprawdzenie artykułów na temat różnych produktów, od suplementów diety po leki.
Informacje o środkach podjętych przez naszą kancelarię
Kancelaria prawna Monolith to firma prawnicza z bogatym doświadczeniem w dziedzinie IT, a w szczególności w zakresie prawa internetowego. W naszej kancelarii oferujemy usługi takie jak sprawdzanie legalności artykułów i stron docelowych (LP), tworzenie wytycznych oraz sprawdzanie próbek dla różnych podmiotów, takich jak operatorzy mediów, operatorzy stron z recenzjami, agencje reklamowe, producenci suplementów diety i kosmetyków D2C, kliniki, operatorzy ASP i inni. Szczegóły są opisane w poniższym artykule.
Zakres usług oferowanych przez Kancelarię Prawną Monolith: https://monolith.law/operationofmedia[ja]
Category: General Corporate